X-ray imaging using SR
Phase-contrast X-ray imaging
X線は波長の短い電磁波で、図1に示すように試料を透過する際に吸収による振幅(強度)の減少に加えて、位相の変化(位相シフト)も生じます。エネルギーが10 keV以上の硬X線領域において、窒素や炭素など軽元素における位相シフトの散乱断面積(複素屈折率の実部の1からの差)は、振幅変化の散乱断面積(複素屈折率の虚部)に比べて1000倍以上大きいという特徴があり(図2)[1]、位相シフトを画像化する「位相コントラストX線イメージング法(位相イメージング法):phase-contrast X-ray imaging」は、従来の強度変化を画像化する吸収イメージング法に比べて極めて高い感度を有します。このため、軽元素から主に構成されている生体の軟部試料や、ポリマー等の有機材料を高精細に無造影・低被曝・短時間に観察することが可能です。。さらに、位相シフトの散乱断面積はエネルギー依存性が低いために、高いエネルギーのX線に対しても感度が高いことや、位相と吸収の2つの物理量から実効的な原子番号を取得できるなどの特徴もあります。
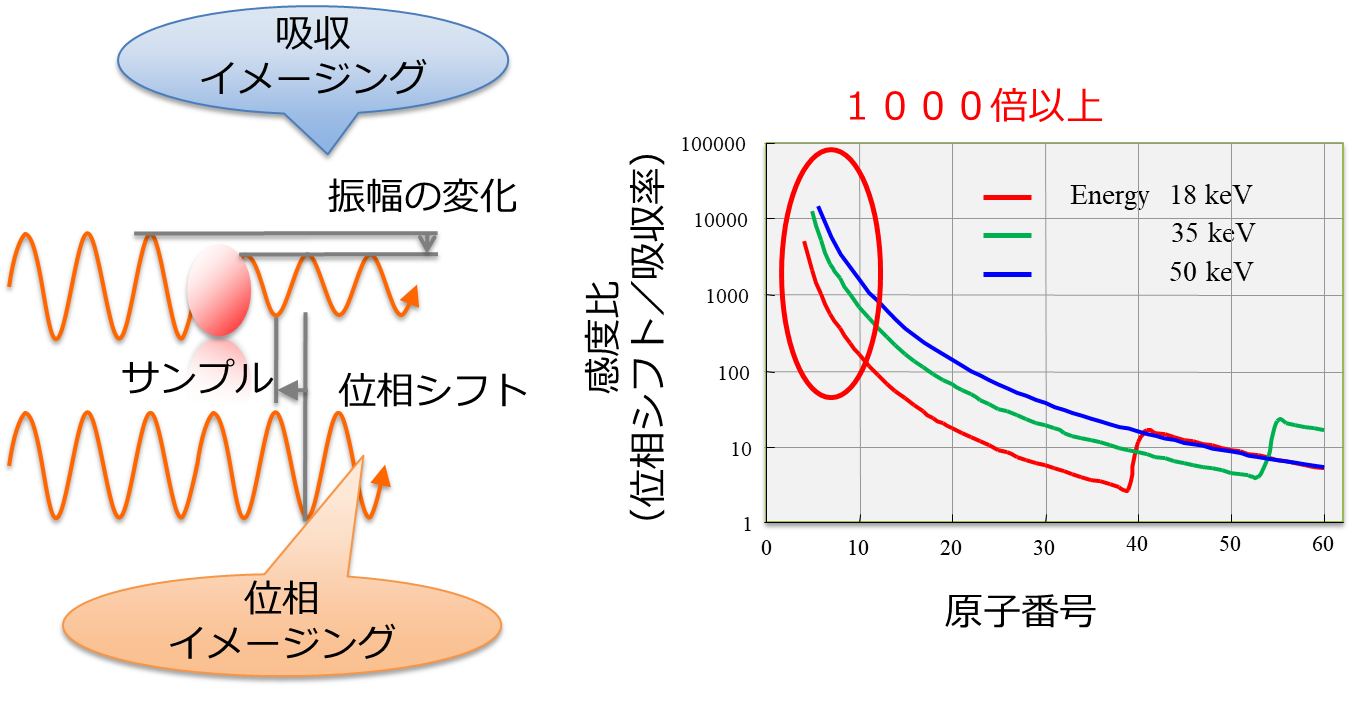 図1 サンプルを透過する際に強度に加えて位相も変化。位相の変化を画像化する手法が位相コントラストX線イメージング法
図1 サンプルを透過する際に強度に加えて位相も変化。位相の変化を画像化する手法が位相コントラストX線イメージング法
図2は同じX線の照射線量で取得したラット心臓の2次元像です。吸収コントラスト像では太い血管が僅かに見えている程度ですが、位相コントラスト像では、血管に加えて、心房や心室が非常に鮮明に可視化できていることがわかります。このように、位相イメージングは従来のレントゲンの限界を打破する非常に大きな可能性を秘めているイメージング法です。
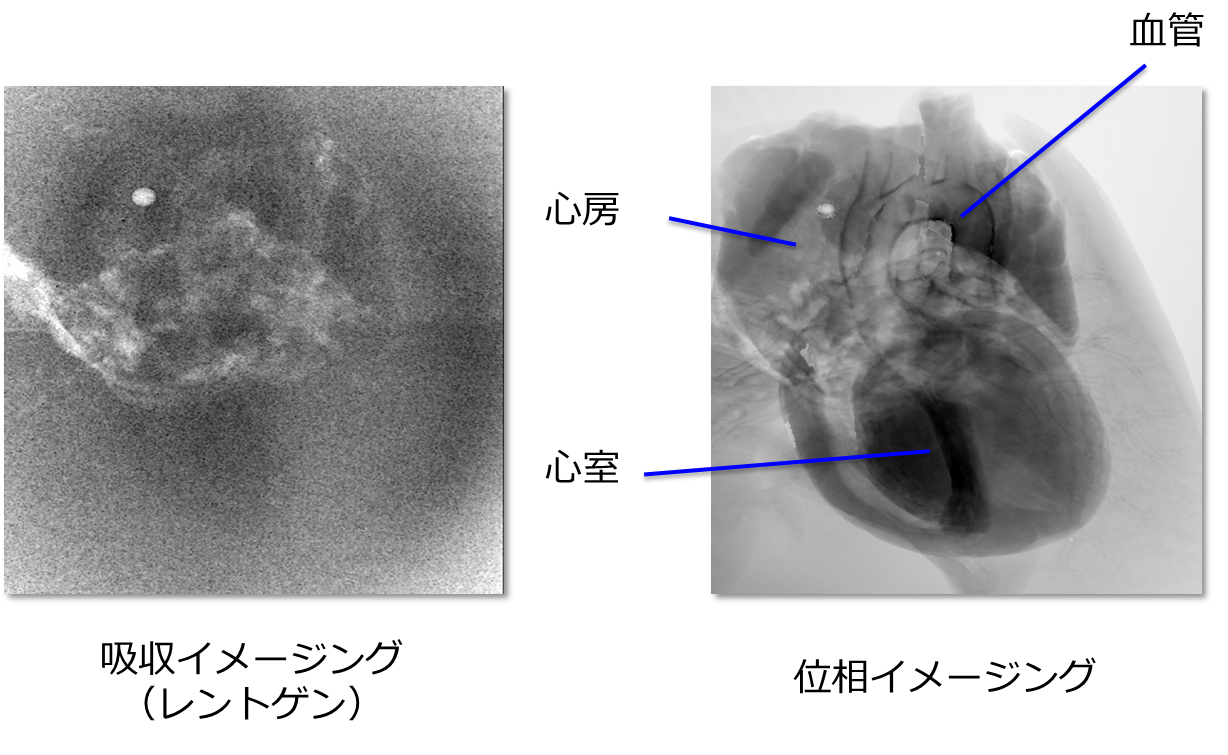 図2 ラット心臓の撮像例。吸収コントラスト像(左)と位相コントラスト像(右)
図2 ラット心臓の撮像例。吸収コントラスト像(左)と位相コントラスト像(右)
現在の技術ではX線の位相シフトを直接検出できないため、検出可能な強度変化に変換して検出する必要があります。これまでに、大視野イメージングを対象として
- 単結晶のX線干渉計を用いて、波の重ね合わせにより位相シフトを検出するX線干渉法(Crystal-based X-ray interferometry)[1]
- サンプルによって生じたX線の屈折(位相シフトの空間微分に比例)を下流に設置したアナライザー結晶の回折により検出する屈折コントラスト法(DEI: Diffraction-enhanced imaging)[2]
- サンプルによって生じたX線の屈折を回折格子干渉計(タルボ干渉計)により検出するタルボ干渉法(Grating-based X-ray interferometry)[3]
- サンプルより十分離れた距離に生じるフレネル縞(位相シフトの2階微分)により検出する伝搬法(Propagation imaging)[4]
の4種類が主に研究・開発されています。いずれの方法も原理及び使用するデバイスが大きく異なるため、密度分解能、空間分解能、及び時間分解能が異なり、図3のような特徴があります[5]。
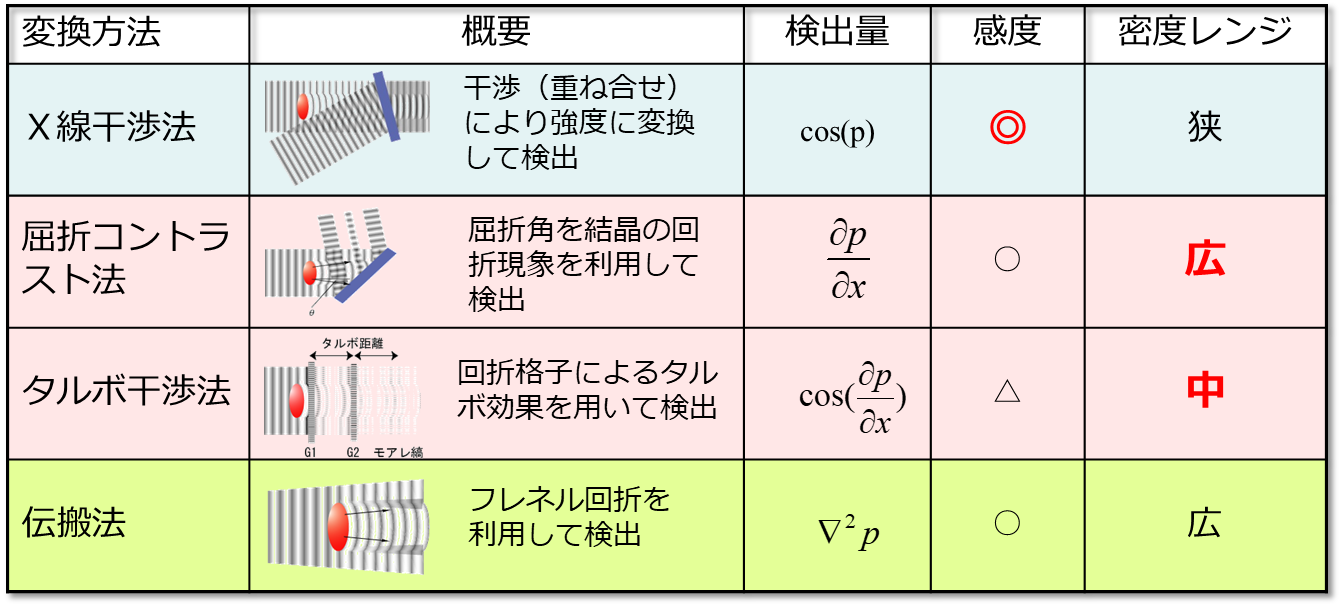 図3 大視野位相イメージングの種類とその特徴
図3 大視野位相イメージングの種類とその特徴
X線干渉法では波の重ね合わせによって位相シフトそのものを検出しているので、位相シフトの空間微分を検出している他の方法に比べて感度が1桁以上高いという特徴があります[6]。このため、疾患や加齢に伴う生体軟部組織内の極僅かな密度差(<mg/cm3)の可視化などに適しています。屈折コントラスト法は、密度のダイナミックレンジが非常に広いという特徴があり、骨や石灰化などを含む密度差の大きな生体試料の観察に適しています。伝搬法は、X線光学素子が不要で画像のボケが少ないために、空間分解能が高いという特徴があります。このため、ミクロンオーダーの顕微的な観察に適しています。以上の3手法は何れも単色・高輝度・平行なX線が必要で、多くの場合において放射光施設で計測が行われています。一方、タルボ干渉法は感度や空間分解能で他手法には及びませんが、準単色かつ発散X線も利用可能で、X線管球でも十分な強度を確保できるという特徴があります。このため、実験室や病院への設置を目標とした開発が進められています。当センターは、上記の4手法すべてを実施可能な世界でも例のない施設です[5]。
X線干渉法
結晶X線干渉計は,単結晶のX線回折を利用してX線の分割・反射・重ね合わせを行う干渉計です。ラウエケース、ブラッグケース、及び両者を組み合わせたいろいろな構成の干渉計がありますが、一般には図3に示すトリプル・ラウエケース(LLL、ボンゼ・ハード型)が利用されていります[7]。光学素子の構成は可視光領域のマッハ・ツェンダー型干渉計と同じで,入射したX線は1枚目の結晶歯(S)でラウエケースのX線回折により物体波と参照波に分割され、2枚目の歯(M)でそれぞれ回折され、3枚目の歯(A)で結合して2本の干渉ビームを形成します。物体波の光路にサンプルを設置すると、サンプルによって生じた位相変化(位相シフト)は、波の重ね合わせによって干渉ビームの強度変動となって現れますので、この強度変化から位相シフトを定量的に検出することができます。
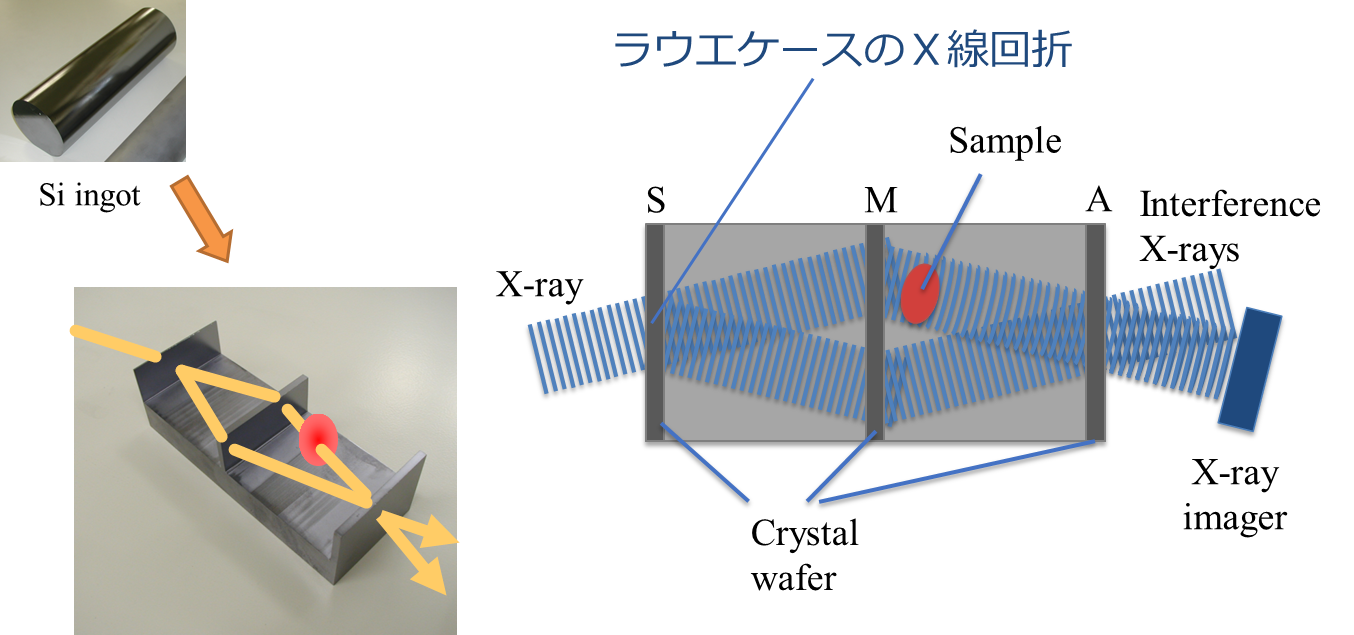 図3 結晶X線干渉計の模式図
図3 結晶X線干渉計の模式図
他の位相イメージング法では位相シフトの空間微分を検出しているのに対して、本法では位相シフトそのものを検出しているので、感度が非常に高く、高エネルギー加速研究機構(KEK)の放射光施設(Photon Factory(PF))のBL-14Cに常設されている本法のイメージングシステムでは、密度分解能が0.3 mg/cm3に達しています[8]。そして、その高感度特性を利用して、疾患や加齢に伴う僅かな密度変化の可視化[9]、無造影での腫瘍と正常組織の識別[10]、発生過程の解明[11]などバイオメディカルへの応用に加えて、南極氷床から掘削した古い氷に含まれるエアハイドレート(雪に閉じ込められた気泡)やメタンハイドレートなどの極低温下での詳細な観察[12]、リチウムイオン電池内の電解液イオン濃度のオペランド(動作中)観察[13]なども行われています。さらに、熱膨張に伴う僅かな密度変化を利用したX線サーモグラフィー[14]や、位相と吸収の比から実効的な原子番号を可視化するZeffイメージング法[15]など新規なイメージング法も開発されています。
屈折コントラスト法(DEI)
屈折コントラスト法はアナライザー結晶と呼ばれる完全結晶の平板を用いて、サンプルによって生じた屈折角(Δθ,位相シフトの空間微分に比例)をX線回折により強度に変換して検出する方法です(図5)。X線はブラッグ角を中心とする極めて狭い角度範囲(数秒)でのみアナライザー結晶で回折されるため、試料を待避した状態で回折X線の強度が半分となるようにアナライザー結晶の角度を調整しておくと、試料によって低角側に屈折されたX線の回折強度は減少し(青矢印)、広角側に屈折されたX線の強度は増加することになります(赤矢印)。すなわち、アナライザー結晶は非常に精度の高い角度アナライザーとして動作するので、回折X線の強度から位相シフトの空間微分量を検出できます。なお、1枚の回折像だけでは吸収による強度の減少と屈折による強度の変化を区別することができないため、一般にはアナライザー結晶をブラッグ角近傍で角度走査して複数枚の投影像を取得し、計算によって位相微分像や擬似吸収像を求めています。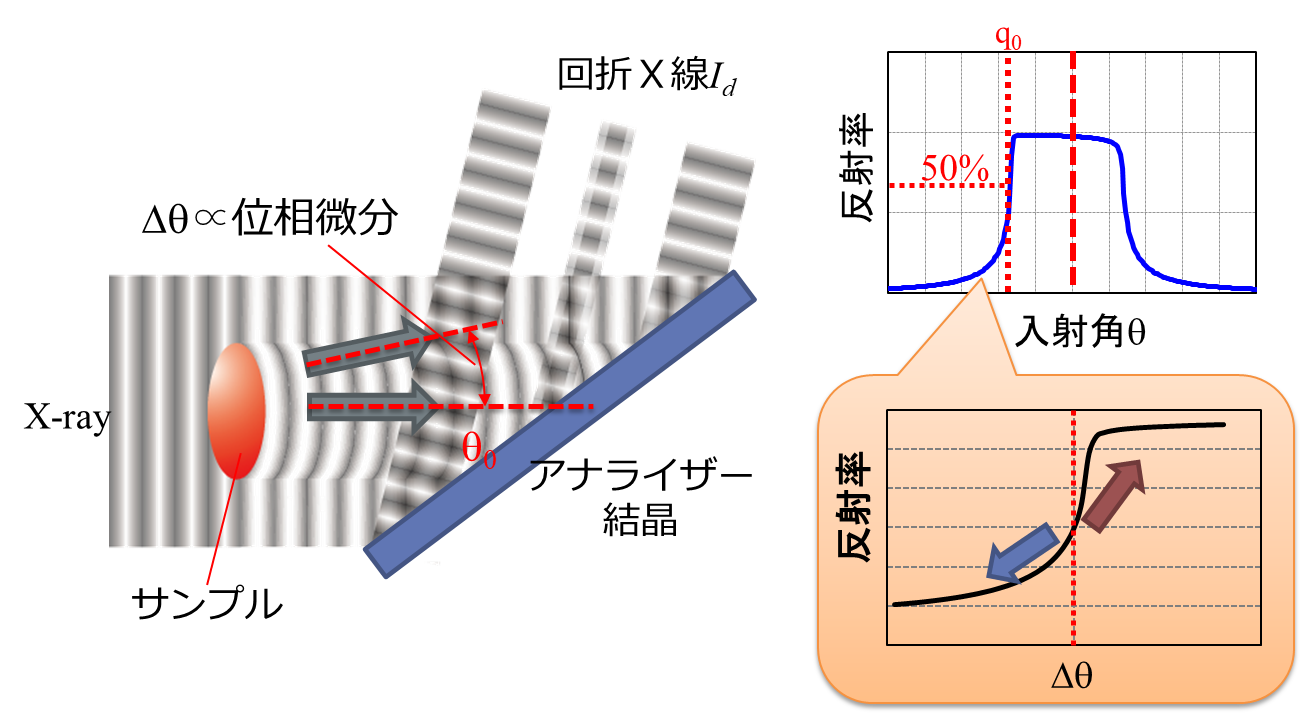 図5 DEIの原理
図5 DEIの原理
本法では、アナライザー結晶の角度走査範囲が広いほど密度のダイナミックレンジが拡大し、より重い元素を含んだ試料の観察も可能になります。その一方で密度分解能は低下し、測定時間も増加するという問題があります[6]。このため,一般には試料の密度分布に応じた点数(3~15点)で計測を行います。なお、当センターではステップ角度スキャンと連続試料回転を組み合わせることで、アナライザー結晶の走査数が15点であっても1時間程度の計測時間を実現しています[16]。
回折格子干渉法(タルボ干渉法)
回折格子干渉法は,2枚の回折格子(上流の位相格子G1と下流の吸収格子G2)から構成された回折格子(タルボ)干渉計(図6)を用いて、サンプルによって生じたX線の屈折角(位相シフトの空間微分)を検出する方法です。他の方法が単色かつ平行なX線を必要とするのに対して、本法は準単色かつ発散X線でもどうすることが大きな特徴で、放射光だけでなくマイクロフォーカスX線管などでも、実用的な計測時間で撮像を行うことができます。このため、工業用及び診断用装置として近年活発に開発が進められています。また,放射光の挿入光源(アンジュレーター)から放射された極めて強い白色や準単色の放射光と組み合わせることで高速な位相イメージングやCT[17]も可能で、レーザー加工時のアブレーションの経時観察[18]などへの適用も個なわれています。
本法では、位相微分像に加えて吸収像と散乱像も同時に取得できます。散乱像は小角散乱と同様に被写体の微細な構造によるX線の「波面の乱れ」に対応することが示されていて[19]、位相や吸収像とは異なった画像になります。図6は当センターのBL07においてホウセンカの種を対象とした観察結果で、散乱像では内部の微細な構造を可視化できています[5]。なお、屈折コントラスト法でもX線回折の角度幅から同様な散乱像を算出することもでき、今後活用が期待されます。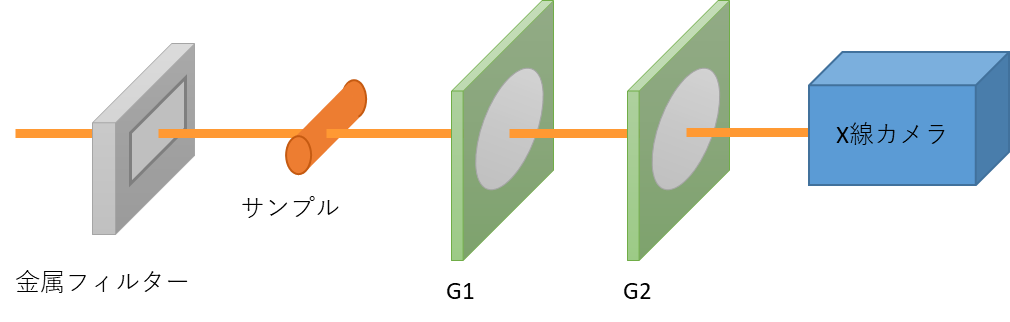 図6 回折格子(タルボ)干渉計の原理図
図6 回折格子(タルボ)干渉計の原理図
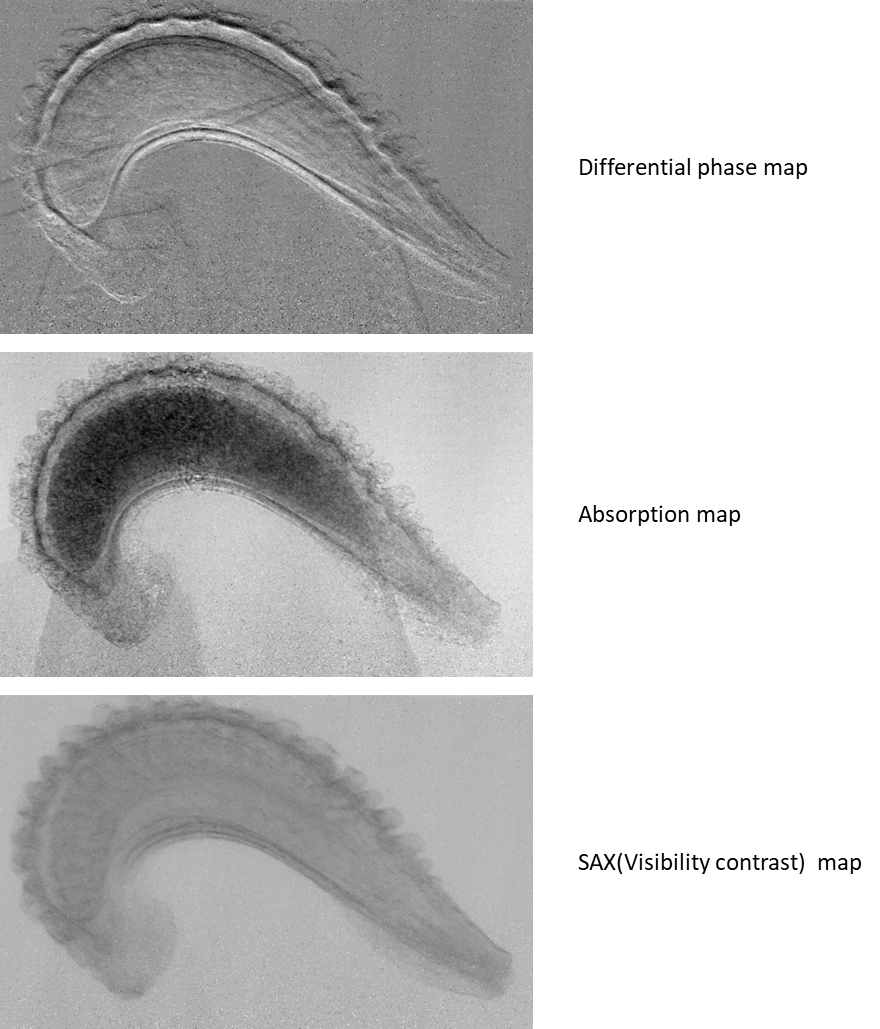 図7 ホウセンカの観察例
図7 ホウセンカの観察例
伝搬法
放射光など比較的可干渉性の高いX線では、サンプルの下流遠方にフレネル干渉縞が生じます。この干渉縞から計算によって位相シフトを求める方法が伝搬法です。従来の吸収イメージングと同じX線光学系の配置で、カメラ長(サンプルとX線画像検出器の距離:PD或いはWD)を変えて複数回の計測を行い、取得した複数のCTデータセットから計算により位相を回復します。他の位相イメージング法とは異なり、干渉計や結晶など新たにX線光学素子の追加が不要で、空間分解能が高いことが大きな特徴になります。なお、最近ではサンプル内部の組成(複素屈折率)がほぼ均一な物質であれば(と仮定して)、単一距離で取得したCTデータから位相を回復する方法(Image Jのプラグインとしても公開されています。)も開発されています[20]。
図7は琥珀に閉じ込められた昆虫(ヌカガ)を、サンプルとカメラの距離(WD)を変えて撮像した結果です[21]。WDが大きくなるに従って、エッジが強調されて羽などがより鮮明に描出されていることがわかります。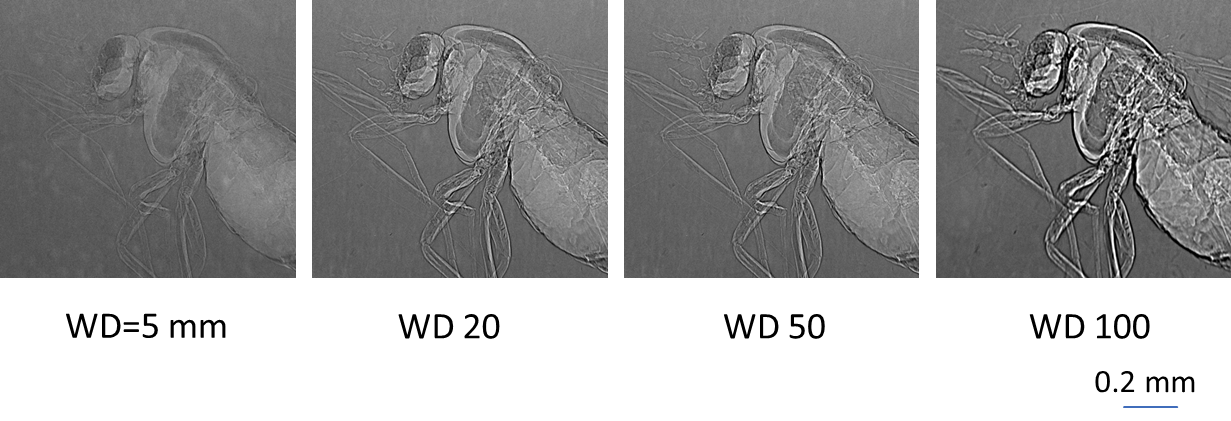 図8 伝搬法の計測例[21]。WDが大きくなるに従って、エッジが強調されている。
図8 伝搬法の計測例[21]。WDが大きくなるに従って、エッジが強調されている。
[1] Momose, A. and J. Fukuda (1995). "Phase-contrast radiographs of nonstained rat cerebellar specimen." Medical Physics 22(4): 375-379.
[2] Davis, T. J., et al. (1995). "Phase-contrast imaging of weakly absorbing materials using hard X-rays." Nature 373(6515): 595-598.
[3] Momose, A., et al. (2003). "Demonstration of X-Ray Talbot Interferometry." Japanese Journal of Applied Physics 42(Part 2, No. 7B): L866-L868.
[4] Snigirev, A., et al. (1995). "On the possibilities high-energy synchrotron of x-ray phase contrast microimaging radiation." Review of Scientific Instruments 66.
[5] Yoneyama, A., et al. (2020). "Four-type phase-contrast X-ray imaging at SAGA Light Source." Journal of Physics: Conference Series 2380: 012117.
[6] Yoneyama, A., et al. (2008). "Quantitative comparison of imaging performance of x-ray interferometric imaging and diffraction enhanced imaging." Medical Physics 35(10): 4724-4734.
[7] Bonse, U. and M. Hart (1965). "An X‐Ray Interferometer." Applied Physics Letters 6(8): 155-156.
[8] Yoneyama, A., et al. (2013). "Phase-contrast X-ray imaging system with sub-mg/cm3 density resolution." Journal of Physics: Conference Series 425(19): 192007.
[9] Lwin, T.-T., et al. (2016). "Spontaneous brain tumor imaging of aged rat by crystal X-ray interferometer-based phase-contrast X-ray CT." Acta Radiologica Open 5(2): 205846011562695.
[10] Takeda, T., et al. (2004). "Interferometric X-Ray Imaging of Breast Cancer Specimens at 51 keV X-Ray Energy." Japanese Journal of Applied Physics 43(8A): 5652-5656.
[11] Yoshioka, H., et al. (2020). "Imaging evaluation of the cartilage in rheumatoid arthritis patients with an x-ray phase imaging apparatus based on Talbot-Lau interferometry." Sci Rep 10(1): 6561.
[12] Takeya, S., et al. (2006). "Observation of low-temperature object by phase-contrast x-ray imaging: Nondestructive imaging of air clathrate hydrates at 233K." Review of Scientific Instruments 77(5).
[13] Takamatsu, D., et al. (2018). "Quantitative Visualization of Salt Concentration Distributions in Lithium-Ion Battery Electrolytes during Battery Operation Using X-ray Phase Imaging." Journal of the American Chemical Society 140(5): 1608-1611.
[14] Yoneyama, A., et al. (2018). "Three-dimensional X-ray thermography using phase-contrast imaging." Sci Rep 8(1): 12674.
[15] Yoneyama, A., et al. (2013). "Feasibility test of Zeff imaging using x-ray interferometry." Applied Physics Letters 103(20).
[16] Yoneyama, A., et al. (2020). "Fast diffraction-enhanced imaging using continuous sample rotation and analyzer crystal scanning." Jounal of Synchrotron Radiation 27(Pt 2): 468-471.
[17] Yashiro, W., et al. (2018). "Millisecond-order X-ray phase tomography with a fringe-scanning method." Applied Physics Express 11(12): 122501.
[18] Vegso, K., et al. (2019). "Development of pink-beam 4D phase CT for in-situ observation of polymers under infrared laser irradiation." Sci Rep 9(1): 7404.
[19] Yashiro, W., et al. (2010). "On the origin of visibility contrast in x-ray Talbot interferometry." OPTICS EXPRESS 18(16): 16890-16901.
[20] Weitkamp, T., et al. (2011). "ANKAphase: software for single-distance phase retrieval from inline X-ray phase-contrast radiographs." Journal of Synchrotron Radiation 18(Pt 4): 617-629.
[21] Yoneyama, A., et al. (2021). "Advanced X-ray imaging at beamline 07 of the SAGA Light Source." J Synchrotron Radiat 28(Pt 6): 1966-1977.